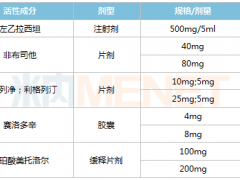
国内科济药业、斯丹赛、博生吉、传奇生物等企业均在布局CAR-T的实体瘤治疗,并已经或正在进入临床试验阶段。
1、科济药业
科济药业无疑是国内实体瘤CAR-T疗法管线布局最多、进展最为迅速的企业,其实体瘤CAR-T疗法包括:
CT041——靶向CLDN18.2蛋白的自体CAR-T细胞候选产品,适用于治疗CLDN18.2阳性实体瘤,主要治疗胃癌/食管胃结合部腺癌(GC/GEJ)及胰腺癌(PC),是全球唯一已获得美国FDA和中国国家药监局及加拿大卫生部的IND/CTA批准并正在进行临床试验研究的靶向CLDN18.2的CAR-T细胞候选产品。今年3月,CT041于北京大学肿瘤医院完成了中国确证性Ⅱ期临床试验的首例患者入组,主要治疗既往接受过至少二线治疗失败的Claudin18.2(CLDN18.2)表达阳性的晚期胃癌/食管胃结合部腺癌。科济药业计划于2024年上半年向中国国家药监局提交NDA,并计划于2022年下半年在北美启动2期临床试验,于2024年向美国FDA提交BLA。
CT011——潜在全球同类首创的CAR-T细胞候选产品(人源化GPC3 CAR-T),具有治疗肝细胞癌(HCC)的概念验证临床数据,目前已在中国完成I期试验患者入组,预计在2021年下半年启动II期试验。
CT0180——表达靶向GPC3抗体融合T细胞受体(aTCR)的融合蛋白的自体T细胞产品。临床前研究显示,在小鼠异种移植模型中,CT0180可有效识别和杀死GPC3阳性肝细胞癌细胞并大幅抑制HCC肿瘤生长,体内及体外的细胞因子释放低于GPC3 CAR-T细胞,提升了过继性细胞疗法的安全性及适用性。
CT0181——靶向GPC3抗体融合T细胞受体共表达IL-7细胞因子的自体T细胞产品。临床前研究表明,与GPC3 CAR-T细胞相比,CT0181在具有低细胞因子释放的实体瘤异种移植物中显示出卓越的抗肿瘤功效、T细胞持久性及免疫记忆。

此外,科济药业还有针对间皮素、GFR/EGFRvIII等的实体瘤CAR-T疗法在研中。
产业化方面,科济药业在上海及美国均拥有生产基地,具备端对端的质粒、病毒载体及CAR-T细胞生产能力,能够独立自主地生产CAR-T细胞以支持中国的临床试验,及独立自主地生产慢病毒载体以支持全球的临床试验。其中,科济药业在张江金山基地的GMP生产工厂取得了中国第一张CAR-T细胞疗法的药品生产许可证,预计每年可支持多达2000名患者的CAR-T治疗;在美国北卡罗来纳州的RTP CGMP生产工厂成功通过官方的设施检查,将每年为700名患者提供额外的自体CAR-T细胞产品产能。
2、斯丹赛
2022年4月,斯丹赛宣布FDA已授予其靶向GCC的自体CAR-T治疗产品GCC19CART快速通道资格。GCC19CART是一款用于治疗复发难治转移型结直肠癌(R/R mCRC)的实体肿瘤疗法,专门设计用于靶向并清除表达结直肠癌肿瘤标记物鸟苷酸环化酶C(GCC)的癌细胞。GCC19CART在中国开展的研究者发起的早期临床试验(IRB)中,累计入组35名晚期结直肠癌患者,在剂量爬坡实验中接受了2X10^6的GCC19CART 细胞/千克剂量的8名患者中,观察到了50%的客观缓解率。
斯丹赛计划于2022年年中,在美国启动旨在评估GCC19CART在复发难治转移型结直肠癌患者中的安全性、耐受性及有效性的I期临床试验。
3、博生吉
2022年4月,博生吉开发的靶向B7-H3的嵌合抗原受体(CAR)-T细胞注射液(研发代号:TAA06注射液)临床试验申请获得CDE受理,用于治疗神经母细胞瘤。这也是获CDE受理的首个B7-H3靶向的CAR-T细胞产品。
B7-H3在正常人体组织中表达水平较低,但在人恶性肿瘤如胰腺癌、前列腺癌、卵巢癌、肺癌、透明细胞肾癌、骨肉瘤、尤文肉瘤、神经脑胶质瘤等实体肿瘤中异常高表达。据悉,TAA06注射液前期体内外药效学研究和安全性评价上,取得了优异的数据。该产品已于2022年3月先后获得了FDA的孤儿药认定和罕见病认定。
同时,TAA06注射液也是博生吉申报的首个针对实体瘤适应症的产品,目前博生吉已建成约1万平米的符合GMP规范的全自动CAR-T细胞生产基地,为CAR-T细胞药物的商业化奠定了基础。
4、传奇生物
国内靶向CLDN18.2的CAR-T疗法中,传奇生物的LB1908紧随科济药业的CT041。
LB1908利用了纳米抗体设计,确保了对CLDN18.2具有高度的特异性。临床前研究表明,LB1908 CAR的抗原结合区域与CLDN18.2特异性结合,具有高亲和力。LB1908在体外和体内(人类肿瘤移植小鼠模型)的抗肿瘤作用是靶标特异性的。LB1908仅对表达CLDN18.2的细胞具有细胞毒性,但对人类原代细胞或表达Claudin 18.1的细胞没有细胞毒性。在临床前研究中,LB1908在细胞源性异种移植瘤(或CDX)胃肿瘤小鼠模型和CDX胰腺肿瘤小鼠模型中显示出显著的抗肿瘤效果。


目前,这款CAR-T疗法已经进入剂量递增I期临床试验,在首例接受最低剂量LB1908治疗的患者中,它表现出良好的安全性和初步抗癌活性。
据悉,传奇生物计划进一步扩展在中国的临床试验,并准备在2022年上半年在美提交IND申请。
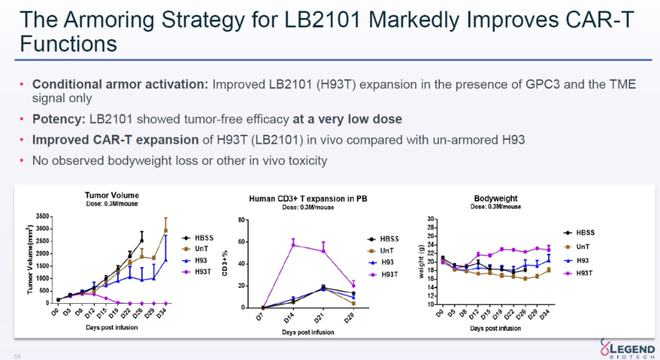
LB2101是传奇生物靶向GPC-3的“武装”CAR-T疗法。它在表达靶向GPC-3的嵌合抗原受体(CAR)以外,还同时表达着一个被肿瘤微环境中的信号激活的跨膜蛋白。因此,它不会影响CAR-T细胞特异性,还能改善细胞的浸润、增殖和持久性。在体外和体内研究显示,LB2101以靶标依赖的方式具有强大的肿瘤杀伤作用,而无脱靶细胞毒性。
5、重庆精准生物
2021年9月,重庆精准生物的CAR-T产品C-4-29细胞制剂靶向治疗“CD70表达阳性的晚期肾细胞癌”适应症获得临床试验默示许可,这也是国内首个针对肾细胞癌实体瘤的CAR-T产品。
据悉,CD70靶点为重庆精准生物国内首创开发,兼具血液和实体肿瘤双应用场景的创新靶点,据此开发的C-4-29细胞制剂,可用于治疗患有复发/难治性多发性骨髓瘤(MM)或晚期/转移性肾细胞癌(RCC)患者。其首个适应症(MM)临床试验于2020年12月10日通过国家药品监督管理局药品审评中心临床试验默示许可,并已启动I期临床研究。
6、信达生物
2022年2月,信达生物宣布其研发的全球首创通用“模块化”抗紧密连接蛋白18.2(Claudin18.2)嵌合抗原受体T细胞注射液(研发代号:IBI345)在治疗晚期Claudin18.2阳性实体瘤的临床试验中完成首例患者给药。
据介绍,IBI345相较于传统CAR-T细胞的潜在优势包括:1)通过利用抗体的“靶向标定”作用,放大抗原靶点信号,引导CAR-T细胞进入肿瘤并启动识别和杀伤效应。2)通过调节抗体给药,调控CAR-T细胞活性,达到控制毒副效应的目的。3)“模块化”CAR-T具有通用性,可以结合不同抗体,通过序贯或同时给予一种以上靶向不同抗原靶点的抗体,治疗抗原表达高度异质性的实体肿瘤或抗原缺失导致的肿瘤复发,从而有望在实体瘤CAR-T治疗中取得突破,并降低CAR-T细胞治疗费用,提高患者CAR-T细胞治疗可及性。