与特应性皮炎相关的瘙痒可导致工作或学习时注意力不集中、睡眠障碍、心理社会困扰等,显著降低患者的生活质量。此外,伴随瘙痒的抓挠行为会导致皮肤症状恶化,并产生恶化的“瘙痒抓挠循环”,进一步加剧瘙痒和皮肤炎症。
对于AD,目前的治疗方案主要是局部类固醇(TCS),这一方案存在有一定的安全风险,并可能由于长期使用损害生长发育。同时,部分病人对现有的治疗方法响应不佳。
近两年AD治疗领域发展迅速,涌现出了许多特异性、创新性的药物靶标。2022年1月,Nature Reviews Drug Discovery发文,总结分析了AD的治疗管线。主要开发疗法可分类为:皮肤微生物调节(减少金葡生长、促进有益共生菌);靶向受损表皮屏障(保湿);靶向先天免疫反应(芳香烃受体、TSLP、IL33、IL1α、IL36R);靶向适应性免疫(抗原呈递、TH2信号通路、IgE、IL22/IL22R、IL23、IL17、Treg、PDE4、H4R、T细胞迁移);靶向搔抓循环(IL31、NK1R、P2X3);JAK抑制剂(局部、系统);其他(TRK、GPCR19、LXR)。
2022年第一季度结束,AD在研管线出现了很多突破性进展,笔者按照药物批准情况和临床进展情况,分别梳理如下:
药物批准情况
1月14日:FDA 批准辉瑞CIBINQO®(abrocitinib)用于成人中重度AD
CIBINQO 是一种选择性JAK1 的口服小分子抑制剂。抑制 JAK1 被认为可调节参与 AD 病理生理学的多种细胞因子,包括IL-4、IL-13、IL-31、IL-22 和TSLP。
图1.辉瑞官网新闻
除了在美国获得监管批准外,CIBINQO还在欧盟、英国、日本、韩国、阿拉伯联合酋长国、挪威、冰岛和新加坡获得了营销许可。
2月10日:FDA接受赛诺菲Dupixent®(dupilumab)治疗6个月至5岁中重度AD儿童的优先审查申请
Dupixent是一种全人源单克隆抗体,可抑制IL-4和IL-13通路的信号传导。如果获得批准,Dupixent将成为美国第一种用于治疗这些儿童不受控制的中度至重度AD的生物药物。目前为止,Dupixent仍然是美国唯一被批准用于6岁及以上患者的生物药。

图2.赛诺菲官网新闻
2月24日:赛诺菲达必妥®(dupilumab)在中国获批儿童适应症,用于治疗外用处方药控制不佳或不建议使用外用处方药的6及以上儿童和成人中重度AD
此次6-12岁儿童适应症的获批,意味着达必妥成为了中国唯一一个涵盖了儿童、青少年、以及成人中重度AD治疗的药物。达必妥分别在2020年6月获得NMPA的批准用于治疗成人中重度AD,在2021年9月获得12岁及以上青少年中重度AD。
3月28日:Maruho“Mitchga皮下注射60mg注射器”在日本获批治疗13岁及以上AD相关瘙痒
Mitchga是一种靶向IL31R,针对特应性皮炎相关的瘙痒的单抗疗法。该产品是一种含有Nemolizumab作为活性成分的皮下注射器,后者是中外制药研发的首个也是唯一一个抗IL-31RA的人源化单克隆抗体。根据既往研究,IL-31是一种神经免疫细胞因子,可诱导瘙痒、炎症和皮肤屏障功能障碍,在AD的发展中发挥重要作用。
相关III期数据已在NEJM发表,首要终点之一,即用药16周后的瘙痒VAS指数得到了明显下降,但AD的重要指标EASI缓解不够明显。不过,这也是所有针对瘙痒的开发药物的共有短板。

图3.Maruho官网新闻
临床进展情况
1月5日:Connect Biopharma公布CBP-201全球IIb期临床详细阳性数据
CBP-201是Connect Biopharma使用其专利免疫调节技术平台(Immune Modulation Technology Platform)发现的一种抗体,所靶向IL-4Rα,是包括AD在内的几种炎症性疾病的有效治疗靶点。
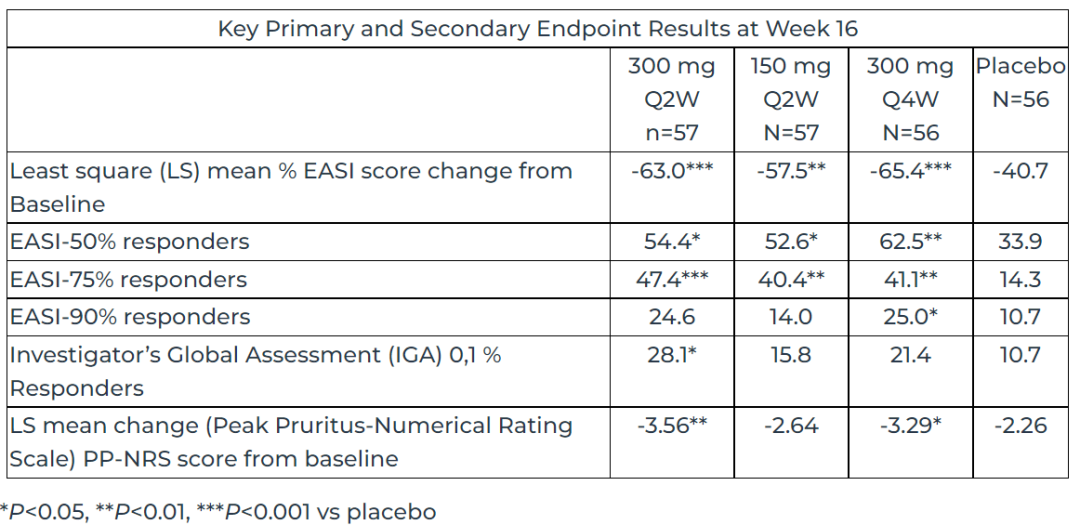
图4.WW001试验主要结果
在接下来的几个月里,Connect Biopharma计划与FDA和有关部门讨论CBP-201数据,并就其计划在中重度AD成人患者中进行的III期临床试验项目寻求反馈。该公司计划于2022年下半年开始启动全球III期临床试验。
2月17日:勃林格殷格翰IL36R单抗Spesolimab完成II期临床
根据ClinicalTrials收录的信息,相关研究状态已更新,但勃林格殷格翰尚未公布具体结果。
Spesolimab是一款IL-36R单克隆抗体,可阻断IL-36R的作用。勃林格殷格翰针对该药物的主要布局,包括泛发性脓疱性银屑病(GPP)、掌跖脓疱病(PPP)、溃疡性结肠炎(UC)、克罗恩病(CD)和AD在内的几种免疫性疾病。
2月22日:AOBiome公布B244在IIb期临床中对瘙痒和AD严重程度均显示阳性结果
图5.四周治疗后WI-NRS平均变化水平
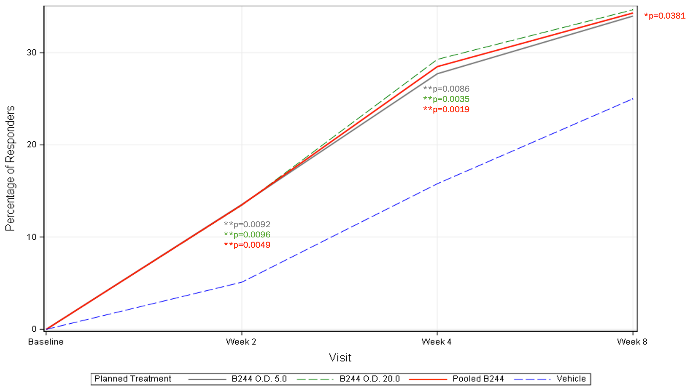
图6.四周治疗后实现EASI75%的病人百分比
B244是一种外用的鼻内配方,其可产生一氧化氮,后者是一种已知的调节炎症和血管舒张的信号分子,可缓解二型炎症。迄今为止,B244在临床研究中被观察到具有良好的耐受性。免疫学研究数据表明,B244可以降低炎症和瘙痒性细胞因子IL-4、IL-5、IL-13和IL-31。
3月22日:Sanofi/Kymab公布Amlitelimab的IIa试验最后一次给药后可维持疗效24周的观察结果
Amlitelimab是一种新型的阻断OX40L的人源IgG4单克隆抗体。OX40L主要作用于包括树突状细胞在内的抗原呈递细胞。通过靶向抗原呈递,Amlitelimab被认为可能在AD中具有长期和持久的抗炎作用。
3月25日:LEO Pharma公布Adbry®(tralokinumab)治疗中重度AD的III期最新3.5年中期安全性和有效性数据
Adbry(tralokinumab)是一种中和IL-13细胞因子的单克隆抗体。IL-13细胞因子在AD体征和症状的免疫和炎症病程中发挥关键作用。Adbry可特异性结合IL-13细胞因子,从而抑制与IL-13受体α1和α2亚基(IL-13Rα1和IL-13Rα2)的相互作用。
Adbry已于2021年12月获得FDA批准用于治疗成人中重度AD。疗效分析显示,在接受tralokinumab治疗长达3年的成年患者中,各种终点(包括AD的严重程度、瘙痒严重程度和生活质量)持续改善。
3月26日:礼来公布Lebrikizumab III期研究进展,大多数患者实现皮肤清除
Lebrikizumab是一种单克隆抗体,旨在以高亲和力结合IL-13,特异性阻止IL-13Rα1/IL-4Rα异二聚体复合物的形成和随后的信号传导。
Advocate 1和2试验中,分别有43%和33%的病人达到IGA 0/1,以及59%和51%的病人达到EASI 75%。ADvocate 1和2的详细52周结果,以及ADhere的16周数据(lebrikizumab与TCS的III期AD研究)将在未来几个月内披露。

图7.礼来官网新闻
礼来和Almirall S.A.计划在完成ADvocate研究后,于2022年底前向世界各地的监管机构提交文件。
3月28日:ASLAN Pharmaceuticals宣布Eblasakimab概念验证研究Ib试验结果
Eblasakimab是一种新型的靶向IL-13受体α1亚基(IL-13Rα1)的单克隆抗体,IL-13Rα1是2型受体的成分之一。
Eblasakimab在第8周时显示出EASI平均百分比变化的剂量依赖性改善。接受600mg QW eblasakimab的患者显示EASI平均降低61%(n=22),接受400mg的患者63%(n=7),接受200mg 50%(n=4)和安慰剂组32%(n=16)。在所有剂量水平下,每个达到EASI-75的患者比例相似:600mg(n=22)为50%,400mg(n=7)为57%,200mg(n=4)为50%,安慰剂组为13%(n=16)。
3月28日:RAPT Therapeutics公布RPT193 Ib期试验生物标志物数据
RPT193是一种通过阻断TH2细胞上高度表达的受体CCR4以选择性地抑制TH2细胞迁移到炎症部位的小分子药物。此次Ib期临床试验数据,与前期的有效性顶线数据一致。作为一项广泛应用评估AD严重程度的基因特征指标,MADAD分数得到了显著缓解。此外,免疫相关通路,包括TH2,TH1,TH22的紊乱信号也有改善。

图8.Globe Newswire新闻报道
总结
当前,AD市场竞争仍然集中在TH2(IL4和IL13)和JAK抑制剂药物之间。值得注意的是,个别药物如IL31R、OX40L也异军突起,有望成为新起之秀。
分析认为,生物制剂起效慢但作用时间长,有利于系统性长期控制病情,相对地,小分子抑制剂如JAK抑制剂,可更加快速广泛地发挥作用,可应用于急性病情控制。而这也可能成为创新突破口之一。






