据了解,自今年1月份开始“港澳药械通”政策试点以来,已审批临床急需使用进口药品9个、医疗器械2个,共惠及150名患者。同时,明确政策扩展实施的首批内地指定医疗机构名单,具体为:香港大学深圳医院(三级医院,试点医院)、广州现代医院(二级医院)、广州和睦家医院(二级医院)、珠海希玛林顺潮眼科医院(二级医院)和中山陈星海医院(三级医院)。
来源:港大深圳医院官微
已审批临床急需使用进口药械11个
为贯彻落实国家市场监管总局、国家药监局等8部委印发的《粤港澳大湾区药品医疗器械监管创新发展工作方案》(以下简称《方案》)中的“在粤港澳大湾区内地9市开业的指定医疗机构使用临床急需、已在港澳上市的药品,使用临床急需、港澳公立医院已采购使用、具有临床应用先进性的医疗器械”重点任务,今年上半年,按照广东省委省政府的部署,在广东省推进粤港澳大湾区药品医疗器械监管创新发展工作联席会议制度的统筹推动下,广东省药品监管局牵头会同省卫生健康委、海关总署广东分署等有关部门和深圳市,在香港大学深圳医院组织开展了“港澳药械通”政策试点。目前试点工作已完成,并取得良好效果,准备将在试点取得的经验做法扩展至粤港澳大湾区其他符合要求的地市和指定医疗机构。
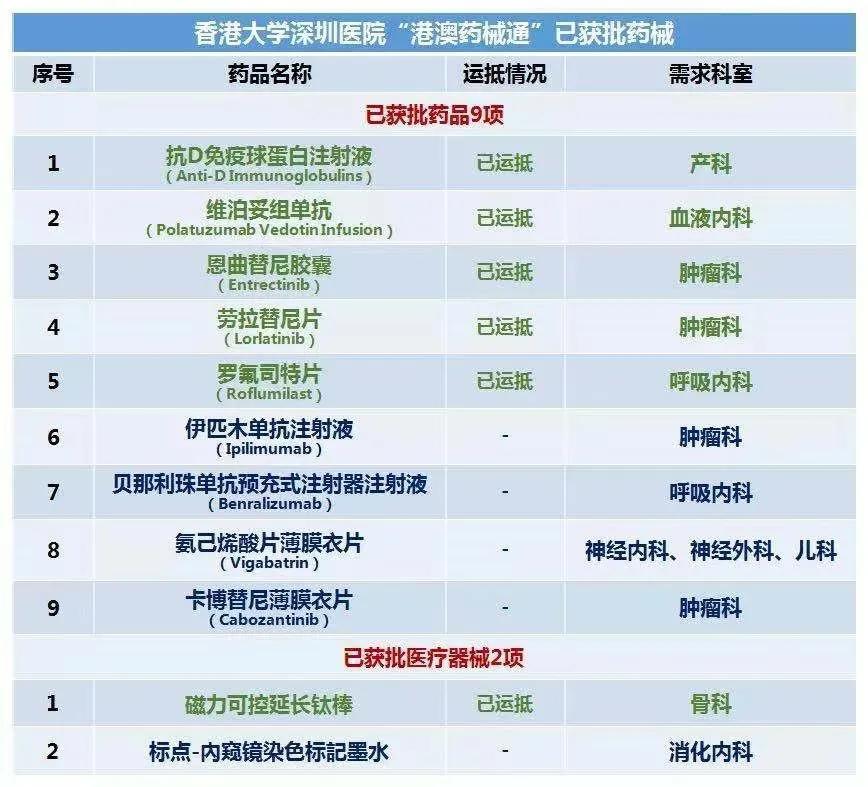
苏盛锋表示,“自今年1月份开始‘港澳药械通’政策试点以来,已审批临床急需使用进口药品9个、医疗器械2个,共惠及150名患者。其中,不乏恩曲替尼、劳拉替尼等目前全球较新的抗癌药品。”在试点期间,广东省药监局牵头建立了全过程追溯管理体系,香港大学深圳医院作为试点医疗机构进一步探索建立了相关药品医疗器械储存及使用管理的制度文件,试点配送企业建立了专有管理标准和操作流程并形成体系。经组织第三方机构对试点工作的评估结果表明,“港澳药械通”政策试点工作建立了健全的管理机制,协作部门职责明确,工作流程顺畅有序,产品安全风险可控,能有效推进粤港澳大湾区医疗质量“同质化”进程,具备了可复制、可推广的基础。
据了解,为在粤港澳大湾区内地9市正式拓展实施“港澳药械通”政策,在全面总结试点工作经验的基础上,广东省药监局牵头组织制定印发了《广东省粤港澳大湾区内地急需进口港澳药品医疗器械管理暂行规定》等政策配套制度文件,明确了指定医疗机构必须具备的条件、进口药械的范围、审批模式、各方责任、风险控制等具体内容及要求。政策文件的制定出台,将为“港澳药械通”政策正式实施构建规范的急需药品医疗器械管理体系,为医疗机构和配送企业等各参与方提供明确指引,为政策在大湾区内地9市的扩展实施提供制度保障。
确定5家首批内地指定医疗机构
根据周紫霄介绍,“目前,广东省卫健委从医疗机构资质力量、合作建设医疗水平和所有制经营形式上等因素综合考虑,按照医疗机构申报、省卫健委审核和研究确定3个步骤组织实施遴选,审核确定了5家首批内地指定医疗机构,涉及广州2家,深圳、珠海、中山各1家。具体为:香港大学深圳医院(三级医院,试点医院)、广州现代医院(二级医院)、广州和睦家医院(二级医院)、珠海希玛林顺潮眼科医院(二级医院)和中山陈星海医院(三级医院)。”接下来,广东省卫生健康委将在指导好首批内地指定医疗机构落实政策规定基础上,结合临床急需的港澳上市药品医疗器械在内地的实际使用情况,适时开展研究补充下一批指定医疗机构。
发布会上还就贯彻落实《方案》有关“简化港澳已上市传统外用中成药进口注册审批流程”政策具体内容进行介绍,并同步公开发布《关于简化在港澳已上市传统外用中成药注册审批的公告》(以下简称《公告》)。
广东省药监局行政许可处处长邱楠表示,“为落实简化港澳已上市传统外用中成药(以下简称港澳外用中成药)注册审批流程,解决粤港澳三地用药习惯趋同而药品注册管理制度不同的问题,广东省药监局在充分听取港澳业界意见的基础上,结合港澳外用中成药上市使用多年、群众习用广泛和外用药剂型安全性相对较高的特点,研究制定相应政策措施,并得到国家药品监督管理局及港澳药品监管部门的支持。”
具体政策措施包括:(一)调整审批事权。港澳外用中成药注册审批事项包括上市注册、上市后变更和再注册,由原来国家药品监督管理局审批,调整为由广东省药品监督管理局实施简化审批。(二)精简申报材料。基于港澳外用中成药上市使用实际情况作为重要证据,遵循外用中成药的特点,可不再提供药物临床试验资料。为避免重复开展相关试验研究,可提供港澳外用中成药原在港澳上市注册时提交的试验研究资料作为相应申报资料。(三)简化审批流程。上市注册审批,通过粤港澳药品监管机制对接,可减少审批流程中的生产现场检查和体系核查环节。上市后变更审批,如相关变更内容在港澳获得批准,可申请调整审批流程改为备案办理。(四)压缩审批时间。上市注册审批的技术审评由原来的200个工作日缩减至80个工作日办结,审批总时限相应由原来的235日减至115日,审批时间压缩一半;上市后变更审批和再注册时限也分别减少50日,进一步压缩审批时间,加快审批进程。(五)优化审批服务。开通全面政策咨询服务,方便港澳企业熟悉内地中成药注册管理政策并获得简化注册审批政策指导。