SKB264为科伦博泰拥有自主知识产权的TROP2抗体偶联药物(TROP2-ADC),于2020年4月获得国家药品监督管理局的默示许可,为首家获批IND的国产TROP2-ADC。据Insight数据库显示,获批临床仅2个月科伦就启动了SKB264的I/II期临床。2022年3月31日,SKB264的一项新适应症刚刚获批II期临床,联合PD-L1单抗泰特利单抗(A167)用于NSCLC。
SKB264国内研发历程
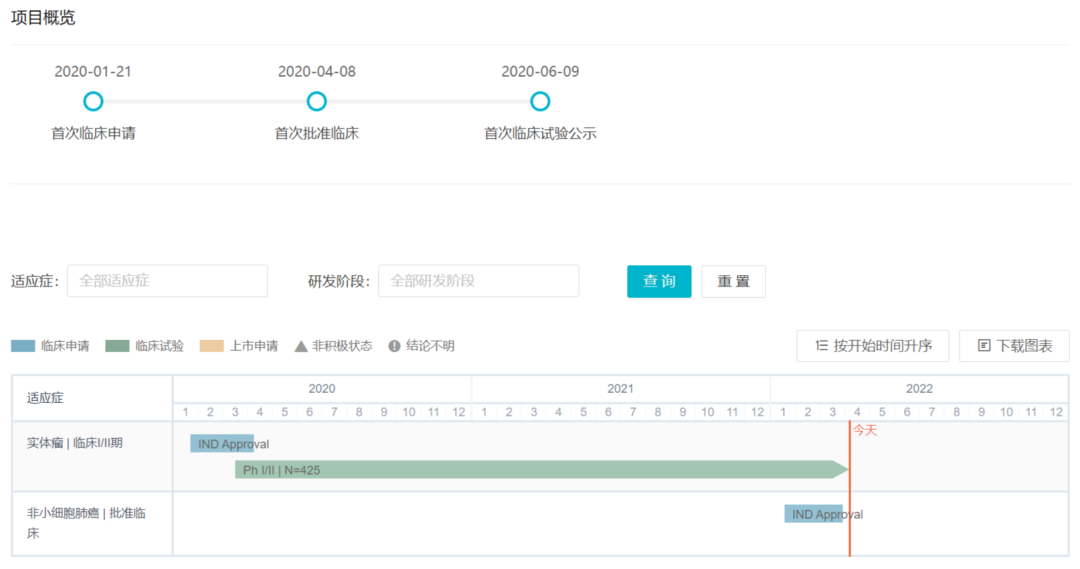
来自:Insight数据库项目进度模块(http://db.dxy.cn/v5/home/)
在2021ESMO及CSCO会议上,科伦公布了SKB264的初步临床数据。这项试验包含I期剂量递增和II期剂量拓展两部分。I期剂量递增研究在中美两地同步开展。
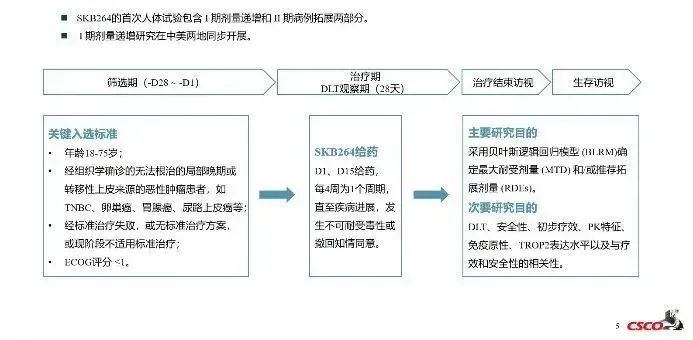
来自:CSCO,科伦药业官微
入组患者均为经过多线治疗失败的、局部晚期或转移性实体瘤患者。截至2021年4月28日,中美共入组18例患者至2、4和6mg/kg3个剂量组,55.6%的患者既往接受过≥4个治疗方案。TNBC患者6例(33.3%)、卵巢癌患者5例(27.8%)、胰腺癌患者3例(16.7%)、尿路上皮癌患者2例(11.1%)、HER2阳性乳腺癌患者和胃腺癌患者各1例。
共有17例患者接受了至少一次疗效评估,总缓解率(ORR)为41.2%(7/17),疾病控制率(DCR)为70.6%(12/17)。5例TNBC患者中有2例PR(ORR为40%),5例卵巢癌患者中有3例PR(ORR为60%),1例HER2+乳腺癌患者获得PR(1/1)。1例胃腺癌患者获得PR(1/1,其靶病灶总和最高减少62.8%,接受SKB264治疗达26.3周且仍在持续缓解)。另有1位胰腺癌患者在接受SKB264治疗后疾病稳定,疾病控制时间达30.3周。表明SKB264对多种实体瘤都产生了较好的疗效反应。

来自:CSCO,科伦药业官微
安全性方面,18例患者均报告了不良事件(AEs),经对症治疗后均可恢复。研究未发生导致死亡的AE。
SKB264的早期临床研究结果显示了在转移性实体瘤患者中良好的耐受性、安全性和令人鼓舞的抗肿瘤活性,在TNBC和卵巢癌中的疗效数据尤为亮眼,在胃腺癌、胰腺癌中也观察到较长时间的持续缓解或疾病稳定,值得进一步探索。
目前SKB264正在II期拓展研究中继续探索一系列适应症,其中针对TNBC的II期拓展入组已经完成,并获得了阶段性临床数据。基于II期拓展临床试验的数据,科伦博泰向CDE提交了SKB264针对至少经二线治疗失败的晚期或转移性TNBC患者开展III期临床试验前的沟通交流申请,并于近日收到CDE的回复意见。科伦博泰将结合监管要求启动注册临床研究,并在首例患者入组时披露。
乳腺癌是严重威胁全世界女性健康的第一大恶性肿瘤,其中TNBC占所有乳腺癌病理类型的10%-20%,预后较其他类型乳腺癌差,对于蒽环类和紫杉类治疗失败的患者,目前并无标准疗法,具有较大的未满足临床需求。






