各国制度框架有一定类似性,但也存在差异,且对化学药和生物药的处理方式不同。这是由各国国情,特别是由各国自身创新药与仿制药产业的发展程度、医药市场特点、司法、行政及医保体系的特点等所决定的。
一般来说,药品专利保护体系除了药品专利链接制度外,还包括橙皮书制度、专利保护期延长、实验数据保护等配套制度,在本文中我们将着重对药品专利链接制度进行解读。
药品专利链接制度解读
2020年10月新《专利法》和2021年7月《药品专利纠纷早期解决机制实施办法(试行)》的实施为新药交易制造了新的法律监管环境,药品专利链接(Drug Patent linkage),是指将申请审批上市的仿制药与其所仿原研药(创新药)的专利“链接”起来,在仿制药上市前提前解决其可能存在的专利侵权问题。
药品专利链接是包含连接药品上市申请审批程序与专利权确权程序及纠纷解决策略的一系列制度,涉及药物监管部门、专利行政部门及司法部门等之间的复杂协作体系。
建立药品专利链接制度的目的在于,在仿制药的上市审批期间确认原创新药专利的有效性,和/或相关仿制药的技术方案是否落入原创新药专利的保护范围,从而在仿制药上市之前解决可能存在的专利侵权纠纷。由此既主动避免了仿制药在上市后侵犯专利原创新药的商业利益,从而打击原研药企长期研发的积极性,又防止了仿制药上市销售、使用后陷入了侵权纠纷而无法继续供应患者,导致对公众利益的损害。
国家知识产权局制定印发的《药品专利纠纷早期解决机制行政裁决办法》第六条规定,化学仿制药申请人提交药品上市许可申请时,应当对照已在中国上市原研药品专利信息登记平台公开的专利信息,针对被仿制药每一件相关的药品专利作出声明。
图 1:四类药品专利声明

来源:公开资料,中国医药工业信息中心整理
根据规定,专利权人或者利害关系人若对四类专利声明有异议,可以自国家药品审评机构公开药品上市许可申请之日起45日内向人民法院提起诉讼或者向国务院专利行政部门请求行政裁决。若错过45天期限,药监局将不会对化学仿制药注册申请设置9个月等待期。对于首个挑战4.1类成功且首仿上市的药品,给予12个月独占期激励,这将使一些原研药受到挑战。
图 2:专利链接制度行政实施流程示意图
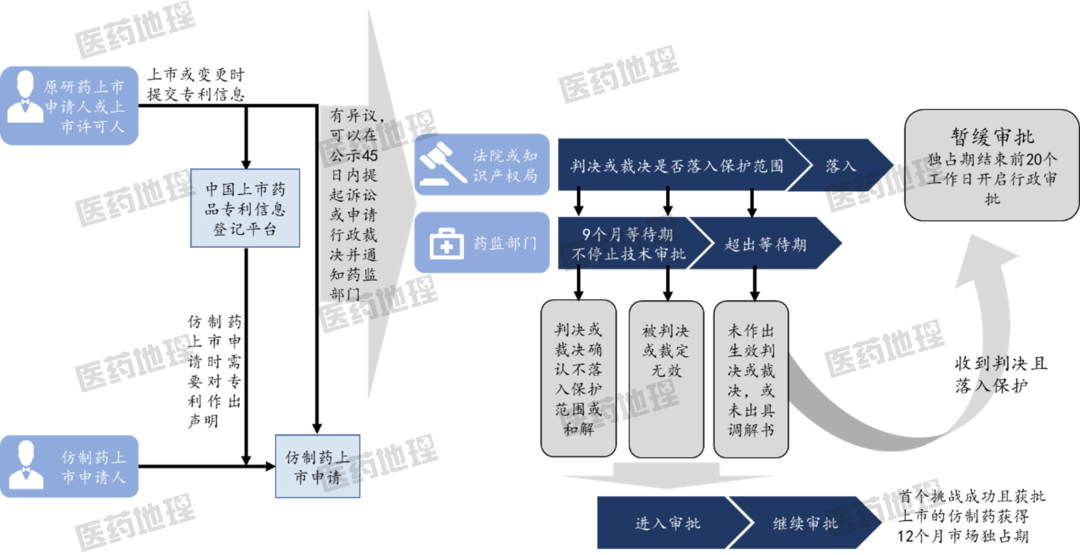
来源:公开资料,中国医药工业信息中心整理
国内药企对药品专利链接制度的实践
自2021年7月初药品专利链接制度拉开序幕以来,有多种药品被发起4.1类挑战,发起专利挑战的仿制药上市申请人包括正大天晴、齐鲁制药、石药集团、豪森药业等多家国内药企。
其中,截至2022年2月的4.1类专利声明共涉及6个药品,分别为南京海陵药业艾多沙班、海昶生物白蛋白紫杉醇、石药集团米拉贝隆、海南合瑞制药达托霉素、正大天晴依维莫司和四川科伦药物研究院瑞戈非尼。
目前专利权人或者利害关系人依旧可以对这6项专利声明提起诉讼或请求行政裁决。这六款产品的简要情况如下。
艾多沙班
艾多沙班是由第一三共开发的一款可直接作用于凝血因子Xa的新型抗凝药物。2018年12月原研甲苯磺酸艾多沙班片在国内获批上市。2021年6月海南先声药业仿制药甲苯磺酸艾多沙班片申报上市,为国内首家。除海陵药业外,2021年8月南京正大天晴对艾多沙班发起4.1类专利声明。
白蛋白紫杉醇
注射用紫杉醇(白蛋白结合型)原研产品Abraxane由Abraxis BioScience研发,后被新基(Celgene)收购,现为百时美施贵宝旗下全资子公司。欧洲药品管理局(EMA)已批准该药用于乳腺癌、转移性胰腺腺癌、非小细胞肺癌的一线治疗。2022年1月13日,科兴生物和海昶生物合作的注射用紫杉醇(白蛋白结合型)境内生产药品注册上市许可获国家药监局受理。
米拉贝隆
米拉贝隆是安斯泰来研发的一款选择性的β3-肾上腺受体激动剂,用于治疗包括尿失禁、尿急和尿频在内的膀胱过度活动症,其缓释片于2011年7月在日本获批,2012年6月在美国获批,2012年12月在欧洲获批,原研米拉贝隆缓释片于2017年10月在我国获批,商品名贝坦利。除石药集团外,2021年12月起齐鲁制药对米拉贝隆发起4.1类专利声明。
达托霉素
达托霉素原研为礼来,礼来将达托霉素开发权授给Cubist Pharmaceutical,后Cubist公司被美国默沙东收购。2003年注射用达托霉素在美国批准上市,用于治疗金黄色葡萄球菌等细菌引起的复杂的皮肤和皮肤软组织感染;2006年FDA批准注射用达托霉素用于成年和小儿患者的金黄色葡萄球菌血液感染。中国批准的适应证与美国类似。
依维莫司
依维莫司片是一种口服mTOR选择性抑制剂,可与胞内蛋白FKBP12结合,进而抑制mTOR的活性。依维莫司片于2003年在欧盟上市,2009年在美国获批,2013年进入中国,获批用于肾恶性肿瘤、星形细胞瘤的治疗;现已在全球120多个国家获批上市,积累了7万多例使用循证。
瑞戈非尼
瑞戈非尼由拜耳原研,是一种口服多激酶抑制剂,可抑制肿瘤形成、肿瘤血管生成、远处转移及肿瘤免疫逃逸。2017年12月瑞戈非尼在我国通过优先审评程序获批用于既往接受过索拉非尼治疗的肝细胞癌(HCC)患者的治疗,是我国首个获批用于HCC二线治疗的新药。2018年,瑞戈非尼进入2017版国家医保目录,2020年成功续约。除四川科伦药物研究院外,2021年9月齐鲁制药对瑞戈非尼片发起4.1类专利声明。
总结
自2021年7月初药品专利链接制度拉开序幕以来,已有多家国内药企入局,对原研药发起专利挑战。可以预见,未来将有更多国内药企发起专利挑战。
对原研药企来说,提前制定应对专利挑战的策略十分重要,包括及时在上市药品专利信息登记平台登记相关专利,以及在完成专利登记后对仿制药的专利声明进行实时追踪。
对仿制药企来说,全面了解重磅药物核心专利技术及到期时间,跟踪全球研发进展,采取专利突破、专利规避等方式绕开专利纠纷、在潜力治疗领域获得领先的仿制药市场地位非常关键,对企业的可持续发展及综合竞争力的提高有着重大意义。






